济宁医疗器械注册检验范围和项目简析
2022-09-22
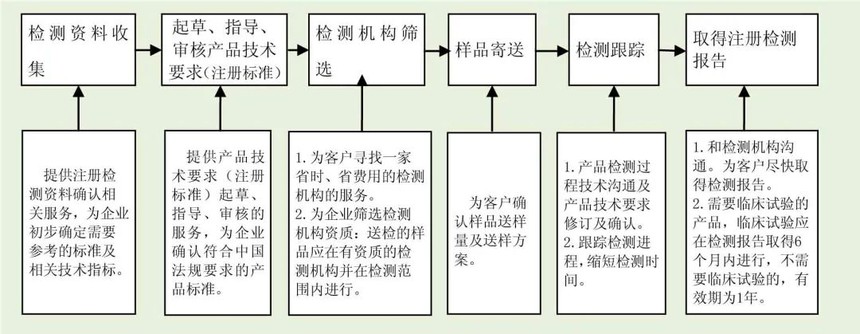
1. 注册检测范围
注册检测是在CFDA认可的检测机构,按照企业自行编制的产品技术要求(产品注册标准)对产品样品的性能指标及随附的产品说明书、标签等进行符合性核查的一个过程。
对于第II、III类医疗器械产品,注册前必须要在经CFDA认可的检测机构取得检测报告,并将检测报告作为注册申请的主要资料之一提交给CFDA进行审查;对于I类医疗器械,备案时可提交企业自测报告或第三方测试报告。
2. 注册检测服务
测试方案及计划的制订,测试项目的确定及豁免项目的申请
协助联系有资质的实验室并协调测试进程
协助起草、制定、审核产品技术要求(注册标准)
协助确定样品量及样品送检过程服务
注册检测进度跟踪、检测过程技术沟通、快速完成注册检测并获得完整报告
3.服务流程
4. 常规检测项目
| 医疗器械分类 检测项目 | 无源医疗器械 | 有源医疗器械 | 体外诊断试剂 | 常规检测项目 |
| 理化性能 | ● | ● | ● | 外观、尺寸、力学性能(高分子材料)、比重、透光度(生物材料)、酸碱度、重金属、炙灼残渣、紫外吸光度、易氧化物、含水量(可吸收材料类)、环氧乙烷残留(EO灭菌的产品)、特性粘度(生物制品、高分子材料类) |
| 生物学性能 | ● | ● | / | 无菌、内毒素、细胞毒性试验、致敏试验、亚慢性毒性试验、皮内刺激试验、急性全身毒性试验、遗传毒性试验、溶血试验、植入试验(根据产品使用周期确认)、 热源试验 |
| 电气安全 | / | ● | / | GB 9706.1电气安全通用要求 GB 9706 电气安全专用要求 YY 0505 电气安全专用要求 并列标准 电磁兼容 GB 4793.1 测试、控制和实验室用电气安全专用要求 并列标准 GB/T 14710 医用电气环境要求及试验方法 |
| 方法学测试 | / | / | ● | 溯源性、测量系统的线性、准确度、分析特异性、精密度、检测限/定量限、稳定性 |
备注:
无源医疗器械根据不同材料组成、预期用途及接触时间,其测试项目也不同。
生物学测试根据ISO 10993.1 /GB/T16886.1的要求进行选择。
有源非诊断类器械执行相应标准:GB 9706.1电气安全通用要求;GB 9706 电气安全专用要求;YY 0505 电气安全专用要求;GB/T 14710 医用电气环境要求及试验方法。
诊断试剂及仪器类执行GB 4793.1测试、控制和实验室用电气安全专用要求;YY 0505 电气安全专用要求;GB/T 14710 医用电气环境要求及试验方法。
推荐
-

-

QQ空间
-

新浪微博
-

人人网
-

豆瓣

